Emerging Infectious Disease ISSN: 1080-6059
Charbon pulmonaire d’origine bioterroriste: les 10 premiers cas rapportés aux Etats-Unis
John A. Jernigan,* David S. Stephens,*† David A. Ashford,* Carlos Omenaca,‡ Martin S. Topiel,§ Mark Galbraith,¶ Michael Tapper,# Tamara L. Fisk,*† Sherif Zaki,* Tanja Popovic,* Richard F. Meyer,* Conrad P. Quinn,* Scott A. Harper,* Scott K. Fridkin,*James J. Sejvar,* Colin W. Shepard,* Michelle McConnell,* Jeannette Guarner,* Wun-Ju Shieh,* Jean M. Malecki,** Julie L. Gerberding,* James M. Hughes,* Bradley A. Perkins,* and members of the Anthrax Bioterrorism Investigation Team(1)
*Centers for Disease Control and Prevention, Atlanta, Georgia, USA; †Emory University School of Medicine, Atlanta, Georgia, USA; ‡Cedars Medical Center, Miami, Florida, USA; §Virtua Health, Mount Holly, New Jersey, USA; ¶Winchester Medical Center, Winchester, Virginia, USA; #Lenox Hill Hospital, New York City, New York, USA; and **Palm Beach County Department of Public Health, West Palm Beach, Florida, USA
Entre le 4 octobre et le 2 novembre 2001, 10 cas confirmés de charbon pulmonaire dus à la dispersion intentionnelle de Bacillus anthracis ont été identifiés aux Etats-Unis. L’enquête épidémiologique a révélé que l’épidémie qui a frappé le District de Columbia, la Floride, le New Jersey et l’état de New York a été causée par l’envoi intentionnel de spores de B. anthracis dans des lettres et des paquets postaux. Nous décrivons le tableau clinique et l’évolution de ces cas. L’âge médian des patients était de 56 ans (de 43 à 73 ans), 70% d’entre eux étaient des hommes et dans tous les cas sauf un, il était certain ou probable qu’ils avaient traité, manipulé ou reçu du courrier contenant des spores de B. anthracis. La médiane du temps d’incubation entre l’exposition et le début des symptômes, connu dans 6 cas sur 10, était de 4 jours (entre 4 et 6 jours). Parmi les symptômes composant le tableau clinique initial, figuraient : fièvre ou frissons (n=10), sueurs (n=7), fatigue ou malaise (n=10), toux minime ou improductive (n=9), dyspnée (n=8), nausées ou vomissements (n=9). La médiane du nombre de globules blancs était de 9,8 x 103/ mm3 (entre 7,5 et 13,3), souvent avec une élévation du nombre de polynucléaires neutrophiles et de métamyélocytes). Neuf patients présentaient une élévation des taux de transaminases sériques, et six étaient hypoxiques. Les 10 patients présentaient des anomalies à la radiographie thoracique: infiltrats (n=7), épanchement pleural (n=8), élargissement du médiastin (n=7). Huit patients ont subi une tomodensitométrie thoracique qui a révélé chez sept d’entre eux la présence d’adénopathies médiastinales. Grâce à une polyantibiothérapie et à un traitement symptomatique, le taux de survie des patients (60%) a été nettement supérieur aux taux rapportés dans le passé (<15%).
Au cours de l’histoire, le charbon humain sous ses diverses formes a toujours été une maladie affectant des personnes en contact étroit avec des animaux ou des produits d’origine animale contaminés par les spores de Bacillus anthracis. Vers le milieu du XIXeme siècle, le charbon pulmonaire lié à l’industrie textile a pris le nom de « maladie des trieurs de laine » en Angleterre (1) et « maladie des chiffonniers » en Allemagne et en Autriche, du fait de la fréquence de l’infection chez les ouvriers des filatures exposés aux fibres animales d’importation contaminées par les spores de B. anthracis. Au début du XXème siècle, des cas humains de charbon pulmonaire en rapport avec les industries textiles et la tannerie ont été rapportés aux Etats-Unis. Dans la dernière partie du XXème siècle, le nombre de cas a diminué de manière spectaculaire grâce à l’amélioration des pratiques d’hygiène industrielle et aux mesures de restriction touchant l’importation de produits d’origine animale (1,2) mais les taux de mortalité sont restés élevés (plus de 85%) (1,3). En 1979 a eu lieu à Sverdlovsk, en ex-URSS, la plus importante épidémie de charbon pulmonaire de tout le XXèmesiècle, apparemment due au largage sous forme d’aérosol de spores de B. anthracis par un établissement militaire(3).
Le dernier cas de charbon pulmonaire recensé aux Etats-Unis avant octobre 2001 remontait à 1976 (1,4). L’identification en Floride, le 4 octobre 2001, d’un cas de charbon pulmonaire chez un journaliste a marqué le début de la première épidémie avérée due à la dissémination délibérée de spores de charbon aux Etats-Unis (5,6). Nous décrivons ici le tableau clinique des10 premiers cas de cette épidémie d’origine bioterroriste.
Méthodes
Entre le 4 octobre et le 2 novembre 2001, les Centers for Disease Control and Prevention (CDC) ainsi que les autorités de santé locales et nationales ont rapporté 10 cas confirmés de charbon pulmonaire et 12 cas confirmés ou suspectés de la forme cutanée de la maladie chez des personnes travaillant dans le district de Columbia, en Floride, dans le New Jersey et à New York (6,7). Une enquête épidémiologique a révélé que cette épidémie était due à l’envoi intentionnel de spores de B. anthracis dans des lettres et des paquets postaux.
Parmi les 10 personnes atteintes de la forme pulmonaire de la maladie, 7 étaient des employés de la poste dans le New Jersey et le district de Columbia qui avaient vraisemblablement été en contact avec des lettres dont on sait qu’elles étaient contaminées par des spores de B. anthracis. Deux autres étaient des employés d’une entreprise de médias en Floride : l’un aurait reçu du courrier contaminé, l’autre l’aurait trié et distribué. Le cas No10 résidait dans l’état de New York, et l’on ignore actuellement comment elle a été exposée au B. anthracis.
Au cours de la réponse à l’épidémie des Services Publics de Santé américains, le CDC, en coopération avec les services de santé locaux et de chaque état, a collecté des données cliniques chez des patients présentant une forme confirmée de charbon pulmonaire, selon la définition de la surveillance épidémique du CDC (8). La collecte a été faite selon diverses méthodes, parmi lesquelles des entretiens avec les patients et les membres de leur famille, l’examen physique des patients, des discussions avec les médecins cliniciens, l’étude des dossiers médicaux et l’analyse de prélèvements cliniques et histologiques.
L’isolement présumé de B. anthracis chez ces patients a été confirmé par lyse par le phage gamma, présence d’une capsule, détection d’antigènes de capsule et de paroi par la technique des anticorps fluorescents et par amplification en chaîne par polymérase (PCR) spécifique de B. anthracis. Tous les isolats ont été confirmés par des laboratoires privés et publics appartenant au National Bioterrorism Laboratory Response Network et par les laboratoires du National Center for Infectious Diseases (NCID) du CDC. D’autres examens ont été effectués au NCID afin de confirmer le diagnostic de charbon pulmonaire (8), parmi lesquels des tests immunohistochimiques utilisant des anticorps de capsule et de paroi de B. anthracis qui ont été effectués sur des prélèvements cliniques, la PCR spécifique de B. anthracis et la détection sérologique des immunoglobulines (Ig)G spécifiques de l’antigène protecteur (PA) de B. anthracis.
Description des cas
Cas No1
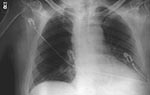
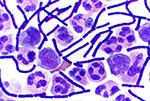
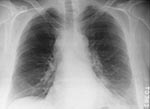
On October 2, 2001, a 63-year-old Caucasian photo editor working for a Florida newspaper awoke early with nausea, vomiting, and confusion and was taken to a local emergency room for evaluation. His illness, which started on September 27 during a trip to North Carolina, was characterized by malaise, fatigue, fever, chills, anorexia, and sweats. No history of headache, cough, chest pain, myalgias, dyspnea, abdominal pain, diarrhea, or skin lesions was reported. Past medical history included hypertension, cardiovascular disease, and gout. He did not smoke. On admission, the patient was alert and interactive but spoke nonsensically. Temperature was 39.2°C, and heart rate 109/min; blood pressure and respiratory rate were normal. Initial pulmonary, heart, and abdominal examinations were reported as normal. No nuchal rigidity was observed. He was not oriented to person, place, or time. Admission laboratory values included a normal total white blood cell (WBC) count, but the platelet count was low. Serum chemistries were normal, except for borderline hyponatremia and elevated total bilirubin. He had mild metabolic acidosis (Table 1). A chest X-ray showed a prominent superior mediastinum and a possible small left pleural effusion (Figure 1). Cerebrospinal fluid (CSF) analysis showed WBC count 4,750/µL (81% neutrophils), red blood cell count 1,375/µL, glucose 57 mg/dL (serum glucose 174 mg/dL), and protein 666 mg/dL. Microscopy examination of the CSF showed many gram-positive bacilli (Figure 2). B. anthracis was isolated from CSF after 7 hours of incubation and from blood cultures within 24 hours of incubation. The patient was admitted to the hospital with a diagnosis of meningitis. After a single dose of cefotaxime, he was started on multiple antibiotics, including ceftazidime, gentamicin, metronidazole, doxycycline, ampicillin, and trimethoprim-sulfamethoxazole. Shortly after admission, he had generalized seizures and was intubated for airway protection. On hospital day 2, penicillin G, levofloxacin, and clindamycin were begun; ampicillin, ceftazidime, and trimethoprim-sulfamethoxazole were discontinued. He remained febrile and became unresponsive to deep stimuli. His condition progressively deteriorated, with hypotension and worsening renal insufficiency. The patient died on October 5. Autopsy findings included hemorrhagic mediastinal lymphadenitis, and immunohistochemical staining showed disseminated B. anthracis in multiple organs.
Le 2 octobre 2001, un rédacteur photo de race blanche, âgé de 63 ans, qui travaillait pour un journal en Floride s’est réveillé tôt le matin avec des nausées et des vomissements et dans un état confusionnel. Il a été emmené au service des urgences local pour examens. Sa maladie, qui avait débuté le 27 septembre au cours d’un voyage en Caroline du Nord, se caractérisait par un état de malaise et de fatigue, de la fièvre, des frissons, un manque d’appétit et des sueurs. Ce patient ne présentait pas d’histoire de maux de tête, ni de toux, douleurs thoraciques, myalgies, dyspnée, douleurs abdominales, diarrhées ou lésions cutanées, mais il avait un passé d’hypertension, de maladie cardiovasculaire et de goutte. Il ne fumait pas. A l’admission, il était conscient et répondait aux questions mais ses propos étaient dépourvus de sens. Sa température était de 39,2°C, son rythme cardiaque de 109 battements par minute ; tension artérielle et rythme respiratoire étaient normaux. Les premiers examens, cardiaque, pulmonaire et abdominal étaient normaux et il ne présentait pas de raideur de la nuque. Il n’avait aucune notion de temps, de lieu ni de personne. D’après les examens de laboratoire effectués à l’admission, le nombre de globules blancs était normal, mais la numération plaquettaire était basse. La chimie sérique était normale, à part une hyponatrémie limite et une élévation de la bilirubine totale. Il présentait une acidose métabolique modérée (Tableau 1). Un cliché thoracique a mis en évidence un médiastin supérieur proéminent avec possibilité d’un petit épanchement pleural gauche (Figure 1). L’analyse du liquide céphalo-rachidien (LCR) a donné les chiffres suivants : nombre de leucocytes 4.750/µl (81% de neutrophiles), érythrocytes 1.375/µl, glucose 57 mg/dl (glucose sérique : 174 mg/dl), et protéines 666 mg/dl. L’examen microscopique du LCR a montré de nombreux bacilles gram-positifs (Figure 2). B. anthracis a été isolé dans le LCR au bout de 7 heures d’incubation et dans des hémocultures au bout de 24 heures d’incubation. Le patient a été hospitalisé sur un diagnostic de méningite. Après administration d’une dose unique de céfotaxime, il a été mis sous polyantibiothérapie associant ceftazidime, gentamicine, metronidazole, doxycycline, ampicilline, and triméthoprime sulfaméthoxazole. Peu de temps après son hospitalisation, il a eu des crises d’épilepsie généralisées et a dû être intubé afin d’assurer le maintien des voies aériennes. Au deuxième jour d’hospitalisation, pénicilline G, lévofloxacine et clindamycine ont été ajoutées au traitement ; ampicilline, ceftazidime, et triméthoprime sulfaméthoxazole ont été abandonnées. Le patient est resté fébrile et a cessé de répondre à la stimulation profonde ; son état s’est détérioré progressivement, avec hypotension et aggravation de l’insuffisance rénale. Il est décédé le 5 octobre. L’autopsie a révélé des adénites médiastinales et la coloration immunohistochimique a mis en évidence la dissémination de B. anthracis dans de multiples organes.
Cas No2
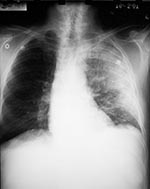
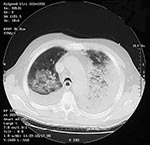
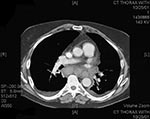
Le 24 septembre, l’employé du service des expéditions qui avait apporté du courrier au patient décrit dans le Cas No 1, un hispano-américain de 73 ans, a été pris d’une grande fatigue. Le 28 septembre est apparue une toux improductive avec poussées de fièvre, rhinorrhée et conjonctivite. Entre le 28 septembre et le 1er octobre, la toux a progressivement empiré et la fatigue s’est nettement aggravée, avec léthargie, apparition de dyspnée à l’effort, de fièvre et de sueurs. Douleurs abdominales modérées et vomissements étaient également présents et sa famille et ses collègues ont signalé des périodes de confusion. Il ne souffrait d’aucune maladie chronique, à part une crise d’ischémie cérébrale passagère remontant au mois d’août 2001 et il ne fumait pas. Il a été hospitalisé le 1er octobre. Sa température était de 38,5°C, son rythme cardiaque de 109 battements par minute, son rythme respiratoire de 20 cycles par minute et sa tension artérielle de 108/61 mm Hg. Il présentait une injection conjonctivale et des rhonchus pulmonaires bilatéraux. Le reste de l’examen, y compris l’évaluation des fonctions neurologiques, ne présentait pas de particularités notables. Aucune lésion cutanée n’était présente. D’après les résultats des examens de laboratoire pratiqués à l’admission, le nombre de globules blancs ainsi que la biochimie sérique étaient normaux, à part une hypoalbuminémie, une élévation des transaminases hépatiques et du taux de créatinine et une hyponatrémie limite. Les taux de gaz sanguins artériels montraient une hypoxie (Tableau 1). La mise en culture des prélèvements sanguins effectués le deuxième jour d’hospitalisation, après le début de l’antibiothérapie, n’a donné aucun résultat. Une radiographique thoracique a mis en évidence des infiltrats localisés dans les lobes supérieur et inférieur évocateurs de pneumonie, ainsi qu’un petit épanchement pleural (Figure 3). Il n’y avait pas d’élargissement du médiastin. On a d’abord administré au patient de l’azithromycine par voie intraveineuse ; céfotaxime et ciprofloxacine ont ensuite été ajoutées. La mise en culture d’un prélèvement nasal effectué le 5 octobre a fait apparaître B. anthracis. La tomodensitométrie (TDM) thoracique a révélé des épanchements bilatéraux et des consolidations pulmonaires affectant plusieurs lobes, mais pas d’adénopathies médiastinales majeures (Figure 4). De l’ADN de B. anthracis a été mis en évidence par PCR dans du liquide sérosanguin obtenu par une thoracocentèse gauche (Tableau 1). La bronchoscopie a montré des sécrétions sanglantes dans le lobe inférieur droit et dans le poumon gauche, avec hyperémie majeure de la muqueuse, marbrures et inflammation. Les cultures bactériennes effectuées à partir d’échantillons de lavages bronchiques et de liquide pleural ont été négatives. Les colorations immunohistochimiques d’une biopsie transbronchique ont mis en évidence des antigènes de paroi et de capsule de B. anthracis. Les recherches de Legionella spp., de bactéries acidorésistantes, de Pneumocystis carinii, de Chlamydia spp., de Leptospira, de Hantavirus et autres pathogènes viraux ont été négatives. Au cours de son hospitalisation, le patient a fait une crise de tachycardie supraventriculaire avec hypotension, maximum de globules blancs de 26.800 par mm3 et nouvel épanchement pleural gauche nécessitant une nouvelle thoracocentèse avec mise en place d’un drain thoracique. De l’ADN de B. anthracis a été identifié par PCR dans le liquide pleural obtenu lors de la seconde thoracocentèse. Une préparation cytologique du liquide pleural et un prélèvement de biopsie pleurale testés par immunocoloration ont montré la présence de capsules et d’antigènes de paroi de B. anthracis. De plus, un test ELISA a mis en évidence dans des échantillons successifs de sérum une augmentation de plus de 400% des taux d’anticorps sériques (IgG) spécifiques de la composante PA des toxines du charbon. L’état du patient s’est amélioré progressivement et il a quitté l’hôpital le 23 octobre sous ciprofloxacine par voie orale.
Cas No3
On September 24, a 73-year-old Hispanic man, the newspaper mailroom clerk who delivered mail to the patient in Case 1, had onset of fatigue. On September 28, nonproductive cough, intermittent fever, rhinorrhea, and conjunctivitis developed. From September 28 to October 1, he had gradual progression of cough, marked worsening of fatigue with lethargy, onset of exertional dyspnea, fever, and sweats. He had mild abdominal pain associated with vomiting, and his co-workers and family noted intermittent periods of confusion. He had no underlying chronic illnesses, with the exception of a transient ischemic attack in August 2001. He did not smoke. He was admitted to the hospital on October 1. Temperature was 38.5°C, heart rate 109/min, respiratory rate 20/min, and blood pressure 108/61 mm Hg. He had bilateral conjunctival injection and bilateral pulmonary rhonchi. Examination, including assessment of neurologic function, was otherwise unremarkable. No skin lesions were observed. Admission laboratory results included normal WBC count and serum chemistries, except for hypoalbuminemia, elevated hepatic transaminases, borderline hyponatremia, and increased creatinine. Arterial blood gas values showed hypoxia (Table 1). Blood cultures obtained on hospital day 2, after initiation of antibiotics, showed no growth. A chest X-ray showed left upper and lower lobe infiltrates consistent with pneumonia and a small left pleural effusion (Figure 3). No mediastinal widening was observed. The patient was initially given intravenous azithromycin; cefotaxime and ciprofloxacin were subsequently added. A nasal swab obtained on October 5 grew B. anthracis. Computed tomography (CT) of the chest showed bilateral effusions and multilobar pulmonary consolidation but no significant mediastinal lymphadenopathy (Figure 4). A left thoracentesis yielded serosanguinous fluid (Table 1) positive for B. anthracis DNA by PCR. Bronchoscopy showed bloody secretions in the right lower lobe and left lung, with severe mucosal hyperemia, mottling, and inflammation. Bacterial cultures of bronchial washings and pleural fluid did not grow. A transbronchial biopsy showed B. anthracis capsule and cell-wall antigens by immunohistochemical staining. Tests for Legionella spp., acid-fast bacteria, Pneumocystis carinii, Chlamydia spp., Leptospira, and Hantavirus and other viral pathogens were negative. The hospital course included an episode of supraventricular tachycardia with hypotension, maximum WBC count 26,800/ mm3, and recurrent left pleural effusion that required repeat thoracentesis and placement of a chest tube. The pleural fluid from the second thoracentesis was positive for B. anthracis DNA by PCR. A pleural fluid cytology preparation and pleural biopsy showed B. anthracis capsule and cell-wall antigens by immunohistochemical staining. In addition, serial serum samples demonstrated a >4-fold rise in levels of serum antibody (IgG) to the PA component of the anthrax toxins by enzyme-linked immunosorbent assay (ELISA). The patient's condition gradually improved, and he was discharged from the hospital October 23 on oral ciprofloxacin.
Le 16 octobre, un afro-américain de 56 ans employé au tri du courrier du service postal américain a été pris de frissons, de maux de tête et de maux de gorge accompagnés d’une fièvre peu élevée, avec sensation de malaise. Toux sèche, oppression respiratoire, essoufflement, sueurs nocturnes, nausées et vomissements sont ensuite apparus. Le 19 octobre, à son arrivée à l’hôpital local il était afébrile et normotendu, son rythme cardiaque était de 110 battements par minute et son rythme respiratoire était normal. Il n’était pas en détresse respiratoire aiguë mais présentait une diminution des bruits respiratoires avec râles bronchiques à la base du poumon gauche Il ne présentait aucune lésion cutanée. Il n’avait pas d’antécédents médicaux particuliers et ne fumait pas. Le nombre total de globules blancs était normal, mais la formule d’Arneth était légèrement déviée à gauche. On notait également une élévation des transaminases hépatiques et de la bilirubine. L’albumine sérique était abaissée mais la biochimie sérique et les fonctions rénales étaient normales. Les taux de gaz sanguins artériels témoignaient d’une bonne oxygénation (Tableau 1). Une radiographie thoracique a mis en évidence un élargissement du médiastin, (en particulier dans la région paratrachéale droite), des masses hilaires bilatérales, des épanchements pleuraux bilatéraux et une petite opacité de l’espace aérien dans le lobe inférieur droit. La TDM thoracique a montré la présence d’un œdème médiastinal diffus, d’importantes adénopathies paratrachéales, subcarinales, hilaires, et dans la loge azygo-œsophagienne (le plus gros ganglion mesurant 4,2 cm de diamètre). Des épanchements pleuraux bilatéraux de taille moyenne étaient également visibles. B. anthracis a poussé dans les onze heures qui ont suivi la mise en culture d’un prélèvement sanguin effectué à l’admission du patient. On a commencé la ciprofloxacine, la rifampine et la clindamycine. Le 21 octobre, le patient était en détresse respiratoire et a été traité par l’administration de diurétiques et de corticoïdes systémiques, avec thoracocentèse à but thérapeutique. Au cours de son hospitalisation, l’épanchement pleural s’est reformé, nécessitant deux nouvelles thoracocentèses. Dans les trois cas, le liquide pleural obtenu était hémorragique. Il n’a pas été nécessaire de mettre en place un drain thoracique. Des vomissements sanglants sont apparus et une endoscopie digestive haute a révélé plusieurs ulcères gastriques peu profonds. Le 28 octobre, le patient a donné des signes d’anémie hémolytique et de thrombocytopénie. Le traitement par plasmaphérèse a amélioré les valeurs hématologiques et le patient reste hospitalisé dans un état stable.
Cas No4
Le 16 octobre, un afro-américain de 56 ans employé du service postal américain a été pris de céphalées modérées, constantes et globales, mais sans altération de la vision ni raideur de la nuque ni aucun autre symptôme neurologique. Au cours des trois jours qui ont suivi, les maux de tête se sont aggravés, avec apparition d’une fièvre peu élevée, de frissons, de maux de gorge, de myalgies, nausées, malaises, sueurs profuses, épisodes de troubles visuels et photophobie. Une légère toux sèche, une dyspnée à l’effort et des douleurs thoraciques de type pleurétique sont ensuite apparues. A son arrivée à l’hôpital le 20 octobre, le patient était afébrile et normotensif, son pouls était de 127 battements par minute, son rythme respiratoire de 20 cycles par minute. Il n’était pas en détresse respiratoire aiguë et l’examen physique n’a rien révélé de notable, si ce n’est une diminution des bruits respiratoires à la base des deux poumons. Ses antécédents médicaux n’avaient rien de particulier et il ne fumait pas. Les examens de laboratoire effectués à son arrivée a l’hôpital étaient normaux, à part une élévation du taux de bilirubine et des enzymes hépatiques, un faible taux d’albumine et une hypoxie (Tableau 1). La tomodensitométrie crânienne sans produit de contraste était normale et l’examen du LCR comptait 4 leucocytes/μl (lymphocytes totaux), 20 hématies/μl avec des taux de glucose et de protéines normaux. La coloration de Gram n’a pas fait apparaître de micro-organismes dans le LCR et les cultures bactériennes n’ont pas poussé. Un cliché abdominal antéro-postérieur a mis en évidence un élargissement du médiastin, des opacités hilaires bilatérales, un épanchement pleural droit et une infection bilatérale de la région périhilaire. Une tomodensitométrie thoracique sans préparation a montré un œdème médiastinal diffus, des épanchements pleuraux bilatéraux, une infection des espaces basilaires et d’importantes adénopathies paratrachéales, sous carinaires, hilaires et dans la loge azygo-œsophagienne. Bacillus anthracis a poussé en 15 heures sur les hémocultures effectuées a l’admission du patient. On a commencé l’antibiothérapie : ciprofloxacine, rifampine et clindamycine. Le 22 octobre, le patient a présenté des signes d’aggravation de la détresse respiratoire et le 23 octobre, il a subi une thoracocentèse à but thérapeutique qui a donné un liquide pleural hémorragique, après quoi son état s’est amélioré. On lui a également administré des corticostéroïdes par voie générale pour spasmes bronchiques. Après une deuxième thoracocentèse, il a pu quitter l’hôpital le 9 novembre.
Cas No5
Le 16 octobre, un afro-américain de 55 ans, employé au service postal du District de Columbia est tombé malade. Il avait de la fièvre, une diaphorèse intermittente, des myalgies, une toux productive de crachats verts mais pas d’essoufflement ni de douleurs thoraciques, pas de symptômes digestifs ni de céphalées. Lors de la consultation de son généraliste le 18 octobre, il avait une température de 38,9°C, un rythme cardiaque et une tension artérielle normaux et un rythme respiratoire de 24 cycles par minute. Les autres résultats d’examens n’avaient rien de particulier mais le nombre de globules blancs était légèrement augmenté (Tableau 1). Il avait des antécédents de diabète sucré et de sarcoïdose mais il était non fumeur. Aucun examen radiologique n’a été effectué et il a été renvoyé chez lui avec un diagnostic de syndrome viral, sans prescription d’antibiotiques. Le 21 octobre, il est arrivé aux urgences avec une aggravation des symptômes, dont striction thoracique, fatigue, frissons, myalgie, nausées, vomissements et essoufflement. Sa température était de 38,9°C, son pouls entre 93 et 150 battements par minute et irrégulier, son rythme respiratoire de 20 cycles par minute et sa tension artérielle de 119/73 mm Hg. Il montrait des signes de détresse respiratoire. A l’examen clinique, il présentait des râles à la base du poumon droit avec sifflements diffus et tachycardie. Le nombre de globules blancs était de 18.800 par mm3, avec une formule leucocytaire de 73% de neutrophiles, 6% de métamyélocytes, 11% de lymphocytes et 8% de monocytes. Le taux d'hématocrite était de 55%, le nombre de plaquettes de 141.000/mm3. Le taux de sodium était de 130 mmol/l, le potassium 5,3 mmol/l, le chlore 99 mmol/l et les bicarbonates 14 mmol/l, avec un trou anionique de 17. Le taux de créatinine était de 1,6 mg/dl, le glucose 425 mg/dl. Les transaminases glutamo-oxalo-acétiques (ASAT) était de 76 UI/l et les transaminases glutamiques pyruviques (ALAT) de 77 UI/l. Les tests de coagulation étaient normaux. Le pH artériel était de 7,42, la PaCO2 de 25 mm Hg, la PaO2 de 66 mm Hg, et la saturation en oxygène de 93% avec 2 litres d’oxygène par minute par canule nasale. Une radiographie thoracique a révélé une densité accrue des tissus mous aux niveaux péritrachéal et hilaire droit avec des infiltrats des lobes moyen droit et inférieur droit évoquant une pneumonie, et un épanchement pleural droit. L’électrocardiogramme a montré une fibrillation atriale. Le patient a été intubé, ventilé et on lui a administré de la lévofloxacine, du diltiazem et de l’insuline. Plus tard, le jour de l’admission, le patient est devenu hémodynamiquement instable, a fait un arrêt cardiaque et il est décédé. B. anthracis a poussé sur les hémocultures. L’autopsie a montré une lymphadénite médiastinale hémorragique et la coloration immunohistochimique a mis en évidence des B. anthracis disséminés.
Cas No6
Le16 octobre, un afro-américain de 47 ans employé des postes, qui travaillait au même centre de distribution de courrier du District de Columbia que les cas 3, 4, et 5, a été pris de toux modérée non productive avec nausées, vomissements et crampes d’estomac. Le 20 octobre, le patient a fait une syncope à l’église mais n’a pas consulté. Tôt le matin du 21 octobre, il est arrivé à un service d’urgence en se plaignant de vomissements et de sueurs profuses. Asthme et calculs rénaux figuraient dans ses antécédents médicaux. Il n’avait pas pris récemment de corticostéroïdes dans le cadre de son traitement antiasthmatique. Il était afébrile et en hypotension orthostatique. Le nombre de globules blancs était légèrement augmenté mais la biochimie sérique et les taux de coagulation étaient normaux. Les transaminases glutamiques pyruviques sériques (ALAT) étaient légèrement augmentées (Tableau 1). Un cliché thoracique initialement déclaré normal mais réexaminé ultérieurement a montré une zone mal définie de densité accrue due à des infiltrats ou à une masse dans la région sus-hilaire. Le patient a été renvoyé chez lui après réhydratation par voie intraveineuse. Le matin du 22 octobre, il est revenu aux urgences, se plaignant de myalgies, de frissons, dyspnée, vomissements incessants et d’une nouvelle syncope. Il avait 35,6°C de température, 76/48 mm Hg de tension artérielle, un rythme cardiaque de 152 battements par minute, et un rythme respiratoire de 32 cycles par minute. Il avait l’air malade, avec une peau marbrée froide au toucher et il était en détresse respiratoire. Il avait des sifflements bilatéraux, de la tachycardie, et un abdomen légèrement distendu avec absence de bruits intestinaux. Le nombre de globules blancs était de 31.200/mm3 avec une formule leucocytaire de 78% de neutrophiles segmentés, 2% de métamyélocytes, 14% de lymphocytes et 3% de monocytes. Le taux de sodium était de 148 mmol/l, les bicarbonates 18 mmol/l, avec un trou anionique de 21, et la créatinine 2.8 mg/dl. Le taux de transaminases glutamiques oxalo-acétiques sériques (ASAT) était de 47 UI/l, les transaminases glutamiques pyruviques sériques (ALAT) de 33 UI/l, les phosphatases alcalines de 197 UI/l. Le temps de prothrombine était de 13,3 secondes et le temps partiel de thromboplastine de 40 secondes. Pénicilline, ceftriaxone, rifampine et lévofloxacine ont été commencées. La détresse respiratoire est apparue, nécessitant une intubation endotrachéale et une ventilation mécanique. Peu après, des signes évocateurs de péritonite sont apparus. Le pH artériel était de 7,13, la PaCO2 de 37 mm Hg, la PaO2 de 106 mm Hg, et la saturation en oxygène de 95% sous intubation avec 100% de FiO2. Une radiographie thoracique a mis en évidence des infiltrats pulmonaire bilatéraux concentrés dans les zones périhilaire et infrahilaire, sans effusion pleurale. La TDM thoracique et abdominale avec liquide de contraste a révélé de gros épanchements pleuraux bilatéraux, des infiltrats périhilaires et sus-hilaires, un œdème médiastinal, un pneumomédiastin, de l’ascite, de l’air dans le système veineux portal, un œdème mésentérique, un œdème diffus de l’intestin grêle, et de petites poches d’air intramural dans différentes parties du jéjunum. La tomodensitométrie crânienne était normale. Le patient est décédé 6 heures après son admission à l’hôpital. Des bacilles Gram-positifs ont été détectés dans la couche leucocytaire et B. anthracis a poussé en 18 heures sur des hémocultures. Les résultats d’autopsie ont montré une lymphadénite médiastinale hémorragique majeure et les examens histopathologiques et immunohistochimiques ont mis en évidence une infection systémique à B. anthracis.
Cas No7
On the evening of October 22, a 59-year-old Caucasian man, contract employee at a U.S. State Department mail sorting facility that received mail from the District of Columbia postal facility associated with cases 3, 4, 5, and 6, became ill. He had drenching sweats, followed over the next 2 days by fatigue, severe myalgias, subjective fever, chills, headache, nausea, vomiting, abdominal pain, cough with scant white sputum, and substernal chest pain. He had no dyspnea or diarrhea. When he arrived at a local emergency room on October 24, temperature was 38.2°C, and heart rate 116/min, and respiratory rate and blood pressure were normal. A complete blood count was normal, and serum electrolytes showed hyponatremia and hypokalemia (Table 1). His past medical history was unremarkable, and he did not smoke. A chest X-ray was initially reported as normal. The patient was thought to have a viral syndrome and was discharged, but blood cultures were obtained and ciprofloxacin was prescribed. He took one dose that night, but vomiting, fatigue, and headache worsened. He also reported transient distortion in his left visual field, and his wife reported that he was intermittently confused. Blood cultures grew gram-positive bacilli after 17 hours of incubation; therefore, on October 25, he was called back to the hospital for admission. The blood isolate was subsequently identified as B. anthracis. At admission, his vital signs were as follows: temperature 38.2°C, heart rate 108/min, respiratory rate 20/min, blood pressure 121/60 mm Hg, and oxygen saturation 94% on room air. He appeared ill and had decreased breath sounds at the right base. The rest of the examination was unremarkable. Laboratory studies on admission included WBC count 9,500/mm3 with 81% segmented neutrophils, 9% lymphocytes, and 9% monocytes, hematocrit 48.1%, platelet count 196,000/ mm3, normal electrolytes and creatinine, SGOT 85 IU/L, SGPT 64 IU/L, alkaline phosphatase 141 IU/L, bilirubin 1.6 mg/dL, and albumin 3.0 mg/dL. On review, the initial chest X-ray showed mediastinal widening (Figure 5), and chest CT on the day of admission showed mediastinal adenopathy with evidence of hemorrhage, normal lung parenchyma, small bilateral pleural effusions, and a suspected small pericardial effusion (Figure 6). Intravenous penicillin and rifampin were added to the ciprofloxacin. His temperature rose to 39°C. Subsquently, vancomycin was added and penicillin was discontinued. On October 26, gastrointestinal bleeding developed, which required blood transfusion, endoscopic injection, and cautery of gastric and duodenal ulcers. On October 27, atrial fibrillation with variable ventricular response developed. On October 28, fever reached a maximum of 39.4°C and then decreased to 38.3°C. On October 30, WBC peaked at 31,300/mm3. On October 31, enlargement of the right pleural effusion required thoracentesis and removal of 900 cc of serosanguinous fluid (Table 1). The patient was discharged from the hospital on November 9.
Le 22 octobre au soir, un homme de race blanche âgé de 59 ans, employé contractuel dans un établissement de tri postal du Département d’Etat qui avait reçu du courrier en provenance de l’établissement du District de Columbia associé aux cas 3, 4, 5, et 6, est tombé malade Il souffrait de sueurs profuses qui les deux jours suivants ont été suivies de fatigue, myalgies intenses, impression de fièvre, frissons, céphalées, nausées, vomissements, douleurs abdominales, toux productrice de petits crachats blancs et douleurs thoraciques rétrosternales. Il ne présentait ni dyspnée ni diarrhée. A son arrivée à la salle des urgences le 24 octobre, sa température était de 38,2°C, son rythme cardiaque de116 battements par minute, avec un rythme respiratoire et une tension artérielle normaux. La numération formule sanguine était normale, et les taux d’électrolytes sériques montraient une hyponatrémie et une hypokaliémie (Tableau 1). Il avait des antécédents médicaux sans histoire et ne fumait pas. Une radiographie thoracique a été effectuée, et d’abord déclarée normale. Un syndrome viral a été suspecté et le patient a été renvoyé chez lui, mais des prélèvements sanguins ont été mis en culture et on lui a prescrit de la ciprofloxacine. Il a pris une dose ce soir-là, mais les vomissements, la fatigue et les céphalées ont empiré. Il a aussi signalé des épisodes de distorsion de son champ visuel gauche, et sa femme a déclaré qu’il avait des périodes de confusion. Au bout de 17 heures d’incubation, des bacilles gram-positifs ont poussé sur les hémocultures et le 25 octobre, il a été recontacté et hospitalisé. L’isolat sanguin a ensuite été identifié, il s’agissait de B. anthracis. A l’admission, ses signes vitaux étaient les suivants : température 38,2°C, rythme cardiaque 108 battements par minute, rythme respiratoire 20 cycles par minute, tension artérielle 121/60 mm Hg, et saturation en oxygène 94% à l’air ambiant. Il avait l’air malade et présentait une diminution des bruits respiratoires à la base du poumon droit. Le reste de l’examen n’a rien révélé de remarquable. Les examens de laboratoire effectués à l’admission ont donné les résultats suivants : nombre de globules blancs 9.500/mm3 avec 81% de neutrophiles segmentés, 9% de lymphocytes et 9% de monocytes, hématocrite 48,1%, numération plaquettaire 196.000/ mm3, électrolytes et créatinine normaux , ASAT 85 UI/l, ALAT 64 UI/l, phosphatase alcaline 141 UI/l, bilirubine 1,6 mg/dl et albumine 3 mg/dl. La radiographie thoracique initiale a été réexaminée, et a montré un élargissement du médiastin (Figure 5), Une TDM thoracique effectuée à l’admission montrait des adénopathies médiastinales avec présence d’hémorragie, un parenchyme pulmonaire normal, de petits épanchements pleuraux bilatéraux, et une suspicion de petit épanchement péricardique (Figure 6). Pénicilline et rifampine par voie intraveineuse ont été ajoutées à la ciprofloxacine. La température du patient est montée à 39°C. Par la suite, de la vancomycine a été ajoutée et la pénicilline a été arrêtée. Le 26 octobre des hémorragies digestives sont apparues, nécessitant des transfusions de sang, des injections par voie endoscopique, et la cautérisation d’ulcères gastriques et duodénaux. Le 27 octobre, une fibrillation atriale avec réponse ventriculaire variable est apparue. Le 28 octobre, la fièvre a atteint un maximum de 39,4°C avant de retomber à 38,3°C. Le 30 octobre le taux de globules blancs a atteint son chiffre maximum de 31.300/mm3. Le 31 octobre, l’épanchement pleural droit avait augmenté de volume et a nécessité une thoracocentèse qui a permis de retirer 900 cm3 de liquide sérosanguin (Tableau 1). Le patient a pu quitter l’hôpital le 9 novembre.
Cas No8
Le 14 octobre, une afro-américaine de 56 ans qui était employée au tri du courrier dans l’agence postale de Hamilton (New Jersey) a été prise de vomissements et de diarrhée, suivis le lendemain d’une impression de fièvre et de frissons qui ne cédaient pas à l’aspirine. Les vomissements et la diarrhée se sont améliorés, mais au cours de 2 jours suivants, elle a eu des poussées fébriles à 38,4°C avec frissons violents, céphalées et fatigue. Une toux improductive est apparue, accompagnée d’un essoufflement modéré et de douleurs thoraciques antérieures à l’inspiration. Elle n’avait ni rhinorrhée ni maux de gorge. Le 19 octobre, la fièvre ne baissant pas et les douleurs thoraciques s’aggravant, elle s’est présentée au service des urgences local. Les examens pratiqués alors ont donné les résultats suivants : température 38,4°C, rythme cardiaque 120 battements par minute, tension artérielle 159/95 mm Hg, et rythme respiratoire 18 cycles par minute. Elle avait l’air malade, faisait des efforts croissants pour respirer, avec une diminution des bruits respiratoires à la base des deux poumons. Elle présentait une croûte de 0,5 à 1 cm de long en cours de cicatrisation sur la face antérieure du cou. Le nombre de globules blancs initial était normal, à part une élévation des métamyélocytes ; hématocrite et plaquettes étaient normaux. Les taux d’électrolytes sériques, la créatinine, et les valeurs de coagulation ne montraient rien de particulier, sauf une hyponatrémie. Il y avait une élévation des enzymes hépatiques et la patiente était hypoxique (Tableau 1). Parmi ses antécédents médicaux figurait une brève crise d’ischémie cérébrale. Elle ne fumait pas. Une radiographie thoracique a montré des infiltrats des deux bases et un petit épanchement pleural droit mais pas d’élargissement du médiastin. Le diagnostic différentiel initial était pneumonie atypique ou charbon pulmonaire, et la patiente a été mise sous lévofloxacine, avec ajout de rifampicine le lendemain. Deux jours plus tard, la fièvre n’avait pas baissé, la dyspnée s’est aggravée et de gros épanchements pleuraux bilatéraux sont apparus. Les antibiotiques ont été remplacés par de la ciprofloxacine, de la rifampicine, et de la vancomycine. Deux thoracentèses ont été effectuées le 21 et le 22 octobre, qui ont permis de retirer respectivement 750 cm3 et 650 cm3 de liquide hémorragique. Le 23 octobre, un drain thoracique droit a été mis en place. Une TDM thoracique effectuée le 22 octobre a mis en évidence des adénopathies médiastinales et cervicales, des infiltrats des deux bases, et un gros épanchement pleural gauche. Le 25 octobre, l’augmentation de volume de l’épanchement gauche a nécessité la mise en place d’un drain thoracique. Le 26 octobre, la fièvre est tombée, les transaminases sont redevenues normales, et la dyspnée a diminué progressivement. Le 30 octobre et le 1er novembre, les drains thoraciques ont été enlevés. Le 5 novembre, la patiente a pu quitter l’hôpital. La recherche d’ADN de B. anthracis dans le sang par PCR a été positive, de même que les examens immunohistochimiques effectués sur des préparations cytologiques de liquide pleural à la recherche d’antigènes de paroi et de capsule de B. anthracis.
Cas No9
Le 15 octobre, une femme de 43 ans originaire de l’Asie du Sud, également employée au tri du courrier à l’agence postale de Hamilton (New Jersey), mais travaillant sur des machines à trier différentes de celles utilisées par la patiente du Cas No8, est tombée malade. Elle présentait des accès de fièvre accompagnés de frissons, une toux sèche avec gêne thoracique et essoufflement, myalgies et fatigue. Elle souffrait également de nausées et de vomissements mais ne présentait ni douleurs abdominales ni diarrhée. Elle se plaignait d’avoir "la tête lourde" mais n’avait ni rhinorrhée ni maux de gorge. Elle souffrait également de céphalées et on avait signalé une légère confusion mentale. Le 16 octobre, lors de la consultation de son médecin généraliste, elle avait une température de of 38°C et a été placée sous lévofloxacine. Elle n’avait pas d’antécédents médicaux notables et ne fumait pas. Le 18 octobre, comme les symptômes persistaient, elle s’est présentée au service des urgences local. Les signes vitaux étaient les suivants: température 38,4°C, rythme cardiaque 120 battements par minute, rythme respiratoire 16 cycles par minute, tension artérielle 141/85mm Hg, avec saturation en oxygène de 92% à l’air ambiant et 97% sous 4l d’oxygène par canule nasale. Elle avait l’air malade et présentait une diminution des bruits respiratoires avec égophonie au niveau de la base du poumon droit. Le chiffre des leucocytes montrait une élévation du nombre de métamyélocytes; l’hématocrite et le nombre de plaquettes étaient normaux. Elle présentait une hyponatrémie, mais le reste des électrolytes, les fonctions rénales et les valeurs de coagulation étaient normaux. On notait une élévation des enzymes hépatiques (Tableau 1). La recherche par PCR d’ADN de B. anthracis dans des prélèvements sanguins effectués deux jours après le début de l’antibiothérapie a été négative. Une radiographie thoracique a montré une opacité hilaire droite compatible avec une condensation ou une masse, ainsi que des épanchements pleuraux, modéré à droite et minime à gauche. Les antibiotiques ont été remplacés par de l’azithromycine et de la ciprofloxacine. Celle-ci a été arrêtée 24 heures plus tard. Le 19 octobre, une radiographie thoracique a mis en évidence une augmentation des tissus mous dans le médiastin (attribuée à des adénopathies), une condensation hilaire droite avec possibilité d’une masse sous-jacente et un gros épanchement pleural droit. Clindamycine et ceftriaxone ont été ajoutées au traitement, et une thoracentèse a permis de retirer 500 cm3 de liquide sérosanguin (Tableau 1). Le test de coloration immunohistochimique effectué sur une préparation cytologique de liquide pleural afin de détecter les antigènes de paroi et de capsule de B. anthracis a été positif. Le 21 octobre, une nouvelle thoracentèse a été nécessaire et 800 cm3 de liquide ont été retirés. Le 22 octobre, une bronchoscopie a révélé une muqueuse œdémateuse et érythémateuse. La coloration immunohistochimique d’un spécimen de biopsie transbronchique a montré la présence d’antigènes de paroi et de capsule de B. anthracis. Des cultures de prélèvements endobronchiques, de liquide pleural, et de prélèvements narinaires n’ont pas révélé la présence de B. anthracis, et aucun autre agent pathogène n’a été identifié. Le 23 octobre, la fièvre est tombée, les autres symptômes ont commencé à s’améliorer, la patiente a été renvoyée chez elle avec un traitement à base de doxycycline le 26 octobre.
Cas No10
Le 25 octobre, une femme de 61ans d’origine asiatique qui travaillait dans la salle de désinfection d’un hôpital new-yorkais a été prise de malaise et de myalgies. Au cours des deux jours suivants sont également apparus fatigue, frissons, douleurs thoraciques, une dyspnée qui s’est progressivement aggravée, et une toux productive de crachats, plus tard teintés de sang ; elle n’a pas signalé de fièvre. Le 28 octobre 2001, lorsqu’elle s’est présentée au service des urgences de l’hôpital local (pas celui où elle travaillait), elle était fébrile et normotensive, mais son rythme cardiaque était de 110 battements par minute et son rythme respiratoire de 38 cycles par minute, avec saturation en oxygène à l’air ambiant de 92% par oxymétrie de pouls. Elle était éveillée, attentive et orientée dans le temps et dans l’espace. Elle présentait une turgescence des jugulaires à 60o. Elle avait un passé d’hypertension mais ne fumait pas. Des râles au niveau des deux apex pulmonaires étaient perceptibles à l’auscultation. Les examens de l’abdomen et du système cardio-vasculaire étaient normaux mis à part une tachycardie, et elle ne présentait pas d’œdème périphérique. Le nombre de globules blancs était légèrement augmenté; l’hématocrite et les plaquettes étaient normaux. La biochimie sérique et le bilan de coagulation étaient normaux, à part une hyponatrémie, une élévation des enzymes hépatiques, et une hypoalbuminémie. Les taux de déshydrogénase lactique sérique étaient de 1.370 UI/l. Afin de garantir à la patiente une oxygénation adéquate, il a fallu la placer sous masque à haute concentration d’oxygène (Tableau 1). L’examen de la radiographie pulmonaire a d’abord conclu à une congestion pulmonaire avec épanchements pleuraux bilatéraux. On a alors commencé le traitement pour insuffisance cardiaque congestive, mais l’échographie cardiaque effectuée dans le service d’urgence a mis en évidence un volume d’éjection normal, l’absence d’anomalie majeure des mouvements de la paroi cardiaque et un petit épanchement intrapéricardique. Le traitement a été remplacé par de la lévofloxacine pour pneumonie atypique. L’état respiratoire de la patiente s’est aggravé et il a fallu l’intuber. Une TDM thoracique a montré des adénopathies médiastinales, une hémorragie médiastinale massive, un épaississement de la muqueuse bronchique, et des épanchements pleuraux bilatéraux. Rifampine, gentamicine et plus tard nafcilline ont été ajoutées à son traitement antibiotique. Le 29 octobre 2001, tôt dans la journée, des drains thoraciques bilatéraux ont été installés et 2,5 litres de liquide sérosanguin ont été retirés du côté droit et 1 litre du côté gauche (Tableau 1). Une bronchoscopie effectuée le même jour a révélé une muqueuse hémorragique sur la totalité de l’arbre trachéo-bronchique, des voies aériennes friables et affaissées, et des sécrétions purulentes dans de multiples lobules des deux côtés. Le 30 octobre, le traitement antibiotique a été remplacé par de la ciprofloxacine plus rifampine, clindamycine et ceftazidime. Des échocardiogrammes successifs ont montré l’augmentation de l’épanchement péricardique qui a abouti à une tamponnade cardiaque. L’état clinique de la patiente s’est progressivement aggravé et elle est décédée le 31 octobre, après une tentative de péricardiocentèse. B. anthracis a poussé sur des hémocultures (au bout de 20 heures) et de liquide pleural. L’autopsie a montré une médiastinite hémorragique et les colorations immunohistochimiques ont confirmé la présence de B. anthracis dans de multiples organes
Résumé clinique
L’age moyen des patients dans cette série était de 56 ans (entre 43 et 73 ans), avec 70% d’hommes, et à part le patient du Cas No10, il était certain ou probable qu’ils avaient tous traité, manipulé ou reçu des lettres contenant des spores de B. anthracis (employés des postes [n=6], employés au tri ou à la manutention [n=2], journaliste [n=1]). L’origine de l’exposition aux spores de B. anthracis dans le Cas No10, qui travaillait dans une salle de stockage, reste inconnue. Quatre patients avaient des maladies cardio-vasculaires ou cérébrovasculaires sous-jacentes, un patient avait des antécédents lointains de sarcoïdose traitée et de diabète sucré équilibré par un régime, un autre avait des antécédents d’asthme. Aucun d’entre eux ne fumait ni n’avait récemment cessé de fumer.
La médiane des temps d’incubation (connus dans 6 cas) entre l’exposition et la survenue des symptômes a été de 4 jours (entre 4 et 6 jours). On pense que deux des patients (les Cas 8 et 9) ont été exposés aux spores de B. anthracis le 9 octobre, jour où une lettre dont on a su plus tard qu’elle était contaminée, a été traitée dans l’agence postale où ils travaillaient. La même lettre est passée par une deuxième agence postale et a été traitée le 12 octobre, jour d’exposition présumé de quatre autres personnes atteintes de charbon pulmonaire (Cas 3, 4, 5, et 6).
La valeur médiane du temps écoulé entre l’apparition des symptômes et la première consultation a été de 3,5 jours (entre 1 et 7 jours). Huit des 10 patients étaient dans la phase initiale de la maladie lors de cette première consultation. Parmi ces huit patients, six ont pris des antibiotiques actifs contre B. anthracis le jour même, et tous les six ont survécu. Quatre patients, y compris celui qui était atteint de méningite, présentaient des signes de maladie fulminante lorsqu’ils ont commencé à prendre des antibiotiques efficaces contre B. anthracis, et tous les quatre sont morts. Le Tableau 2 résume les symptômes des 10 patients atteints de maladie du charbon d’origine bioterroriste. Le Tableau 3 établit une liste des principaux résultats cliniques, biologiques et radiologiques. La médiane des numérations de globules blancs initiales était de 9.800/mm3 (de 7.500 à 13.300/mm3) mais la médiane des valeurs les plus élevées de globules blancs après la première consultation et au cours de la maladie a été de 26.400/mm3 (de 11.900 à 49.600/mm3). Les radiographies thoraciques présentaient des anomalies chez tous les patients, mais seulement sept d’entre eux présentaient des modifications du médiastin.
Dix patients présentaient des épanchements pleuraux qui ont souvent atteint une taille importante au cours de l’hospitalisation chez ceux qui ont survécu. Il a fallu ponctionner du liquide pleural chez sept patients, en utilisant des drains thoraciques chez trois d’entre eux; dans tous les cas, le liquide pleural était hémorragique et contenait relativement peu de leucocytes. Les infiltrats pulmonaires, présents chez sept patients, étaient localisés dans les lobes inférieurs gauche et droit (un patient), les lobes supérieur et inférieur gauches (un patient), le lobe supérieur droit (deux patients), le lobe inférieur droit (un patient), les lobes moyen et inférieur droits (un patient), et les régions périhilaires gauche et droite (un patient). Une TDM a été pratiquée chez huit patients; des adénopathies médiastinales étaient présentes chez tous sauf un.
Des cultures bactériennes ont été effectuées chez sept patients à partir de prélèvements sanguins effectués avant le début de l’antibiothérapie et B. anthracis a été isolé dans les sept cas. La médiane des temps nécessaires à la croissance de B. anthracis sur les hémocultures a été de 18 heures (de 12 à 24 heures). Chez trois patients les premières hémocultures ont été effectuées après le début de l’antibiothérapie et rien n’a poussé. Pour un patient chez qui B. anthracis avait poussé sur les hémocultures, celles-ci ont été effectuées de nouveau après le début de la prise d’antibiotiques efficaces contre B. anthracis et ces cultures n’ont pas poussé.
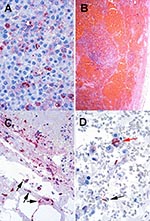
Les examens immunohistochimiques spécifiques de B. anthracis effectués sur des préparations cytologiques de liquide pleural ou des spécimens de biopsie transbronchique ont été positifs chaque fois que ces tissus ont pu être obtenus. (les trois cas non mortels) (Figure 7A). Trois patients ont présenté une arythmie atriale (tachycardie supraventriculaire dans le Cas No2 et fibrillation atriale dans les Cas 5 et 7), et trois patients ont eu un épanchement intrapéricardique visible à la TDM. Une tamponnade péricardique a été suspectée chez un patient. A ce jour, six des 10 patients atteints de charbon pulmonaire ont survécu (taux de mortalité de 40%). Cinq ont pu quitter l’hôpital, un est en convalescence à l’hôpital. La Figure 8 montre la chronologie entre le moment de l’exposition, lorsqu’il est connu, et l’état actuel de ces dix patients. Chez les quatre patients décédés, l’autopsie a mis en évidence une lymphadénite médiastinale hémorragique et une infection disséminée à B. anthracis (Figure 7B , Figure 7C, 7D).
B. anthracis-specific immunohistochemical tests performed on pleural fluid cytology preparations or transbronchial biopsy specimens were positive in every case in which these tissues were available (three nonfatal cases) (Figure 7A). Three patients had atrial arrythmias (supraventricular tachycardia in Case 2 and atrial fibrillation in Cases 5 and 7), and three patients had pericardial effusion on CT scan. In one patient, pericardial tamponade was suspected. Six of 10 patients with inhalational anthrax have survived to date (death rate 40%). Five have been discharged from the hospital, and one is recovering in the hospital. Figure 8 shows the timeline from exposure (when known) to current status for these 10 patients. Autopsy findings in all four patients who died showed hemorrhagic mediastinal lymphadenitis and evidence of disseminated B. anthracis infection (Figure 7B-D)
Discussion
Avant cette épidémie d’origine bioterroriste, 18 cas seulement de charbon pulmonaire avaient été rapportés aux Etats-Unis au cours du XXème siècle (1,4,9-21), le cas le plus récent datant de 1976 (4). La plupart d’entre eux étaient liés à une exposition à des produits d’origine animale, essentiellement dans des filatures utilisant des poils ou des peaux de chèvre ou encore de la laine (1). Les caractéristiques cliniques des 10 cas d’origine bioterroriste décrits ici présentent des similitudes avec les cas rapports antérieurement mais aussi des différences majeures.
Le charbon pulmonaire est décrit comme une maladie clinique en deux phases caractérisée par une phase initiale de malaise, fatigue, fièvre, myalgies avec toux improductive d’une durée de un à quatre jours, suivie d’une phase fulminante de détresse respiratoire, cyanose et diaphorèse (1). La mort intervient un à deux jours après le début de la phase fulminante (2,22). Les symptômes de la phase initiale du charbon pulmonaire dans les 10 cas d’origine bioterroriste (Tableau 1) étaient semblables à ceux des 18 cas d’origine professionnelle décrits dans le passé (1); cependant, les rapports antérieurs n’insistaient pas particulièrement sur la transpiration intense, souvent profuse qui a constitué un trait marquant des cas décrits ici. De même, les rapports précédents avaient noté une brève période d’amélioration entre la phase initiale et la phase fulminante (1) qui n’a pas été observée ici. Nausées et vomissements ont également constitué ici des symptômes fréquents de la phase initiale, suggérant une atteinte digestive précoce. Des lésions digestives ont été observées dans 39 des 42 cas fatals de charbon pulmonaire associés à l’épidémie de Sverdlovsk (23). La plupart de ces lésions semblent avoir été le résultat d’une contamination hématogène de la sous-muqueuse digestive par B. anthracis, sans atteinte des plaques de Peyer ni, dans la majorité des cas, des ganglions lymphatiques.
Le caractère non spécifique de la phase initiale du charbon pulmonaire rend le diagnostic difficile. Aucun des 10 patients atteints de charbon pulmonaire d’origine bioterroriste n’ayant eu une radiographie pulmonaire initiale normale, cet examen semble avoir constitué un indicateur sensible de la maladie. De multiples anomalies ont été notées au cours de cette radiographie pulmonaire initiale, parmi lesquelles un élargissement du médiastin, une densité paratrachéale et hilaire, des épanchements pleuraux et des infiltrats parenchymateux. Chez deux patients les clichés ont d’abord été considérés comme normaux mais des anomalies sont apparues lorsqu’ils ont été examinés par un radiologue (élargissement médiastinal chez un patient et masse périhilaire au lieu d’un infiltrat chez l’autre). Des infiltrats ou des épanchements pulmonaires ont été décelés initialement, mais sans élargissement médiastinal visible. La TDM s’est révélée utile pour mieux caractériser les anomalies pulmonaires médiastinales, et d’une sensibilité plus grande que la radiographie pulmonaire dans la mise en évidence des adénopathies médiastinales.
Chez les patients qui ont consulté un prestataire de soins au cours de la phase initiale, le nombre total de globules blancs était en général normal ou seulement faiblement augmenté lors de la première consultation. Cependant, on a souvent noté une augmentation de la proportion de neutrophiles ou de métamyélocytes qui a constitué un facteur de diagnostic précoce. Au cours de la maladie, on a constaté chez la plupart des patients une augmentation, parfois très marquée, du nombre de globules blancs.
Chez tous les patients qui n’avaient pas été mis sous antibiothérapie préalable, B. anthracis a poussé sur les hémocultures, même au cours de la phase initiale de la maladie. L’étude de modèles animaux suggère que chez les primates atteints de charbon pulmonaire, la bactériémie apparaît très tôt, avant le début de la phase clinique fulminante (24). En revanche, les hémocultures sont rapidement devenues stériles après initiation de l’antibiothérapie, ce qui laisse penser qu’en cas de traitement antibiotique préalable, la sensibilité des hémocultures en tant que test diagnostique risque d’être considérablement diminuée.
Le diagnostic de charbon pulmonaire a été posé chez trois patients sans que B. anthracis ait poussé sur des cultures de prélèvements cliniques. Dans les trois cas, les cultures n’avaient été effectuées qu’après le début de l’antibiothérapie. Chez ces patients, le diagnostic a été établi en fonction d’antécédents ou de risque professionnel ou environnemental d’exposition, devant un syndrome cliniquement compatible. B. anthracis a été identifié dans des prélèvements de liquide pleural, de biopsie pleurale ou de biopsie transbronchique, par coloration immunohistochimique avec des anticorps de capsule et de paroi spécifiques de B. anthracis ou par identification d’ADN de B. anthracis par PCR sur un échantillon de sang ou de liquide pleural. Les données sérologiques obtenues grâce au test ELISA chez un des patients ont aussi montré une augmentation de plus de quatre fois du taux d’anticorps sériques (IgG) contre la composante PA de la toxine du charbon.
Le taux de survie des patients atteints de charbon pulmonaire dans cette série (60%) est plus élevé que les taux rapportés dans le passé (<15%) (1,3). Tous les patients ont été soumis à une polyantibiothérapie comportant plus d'un antibiotique actif contre B. anthracis. L'amélioration apparente du taux de survie par rapport aux cas précédemment rapportés laisse penser que les associations d'antibiotiques utilisées chez ces patients présentent peut-être une supériorité thérapeutique par rapport aux traitements précédents. Le peu de données dont on dispose concernant le traitement des survivants suggèrent que le taux de survie peut être amélioré par l'administration précoce d'une fluoroquinolone et d'au moins une autre substance active (7). Des études concernant la susceptibilité à d'autres antibiotiques des isolats associés à cette épidémie ont été publiées (7). Les isolats de B. anthracis produisent une céphalosporinase (7) qui inhibe l'activité antibactérienne des céphalosporines comme la ceftriaxone, et les céphalosporines ne doivent pas être utilisées pour le traitement. Parmi les autres explications possibles de cette amélioration du taux de survie, on peut citer la précocité accrue du diagnostic et du traitement, un meilleur traitement des symptômes, les différences de pathogénie des souches de charbon pulmonaire d'origine bioterroriste, la susceptibilité variable des hôtes, ou encore la combinaison de tous ces facteurs.
Les épanchements pleuraux ont constitué dans cette série un trait clinique remarquablement constant du charbon pulmonaire, puisqu'ils ont été observés chez tous les patients. De petite taille au départ, ces épanchements ont été caractérisés chez les patients qui ont survécu par leur augmentation progressive de volume et leur persistance. Il a fallu effectuer un drainage de la cavité pleurale chez sept patients, et chez tous, le liquide pleural présentait les mêmes caractéristiques: hémorragique, avec un taux de protéines élevé et relativement peu de leucocytes. Les tests immunohistochimiques ont mis en évidence de grandes quantités d'antigènes de capsule et de paroi de B. anthracis dans les culots de cellules du liquide et du tissu pleural.
Le cas 2 avait cela de remarquable que ce qui dominait à la radiographie pulmonaire était la présence d'infiltrats pulmonaires volumineux et de taille croissante, et non d'un élargissement médiastinal. En fait, la TDM thoracique n'a pas montré d'adénopathies médiastinales. Les biopsies transbronchiques effectuées chez ce patient ont montré la présence d'antigènes de capsule et de paroi spécifiques de B. anthracis dans le parenchyme pulmonaire. Chez les patients atteints de charbon pulmonaire, les rapports antérieurs décrivent une broncho-pneumonie et des infarctus pulmonaires hémorragiques. Abramova et al. (23) décrivent des hémorragies localisées et une pneumonie charbonneuse nécrotique chez 11 des 42 patients décédés. Les caractéristiques de l'aérosol ayant servi à vaporiser les spores ou bien des facteurs spécifiques de chaque hôte ont pu influencer la pathogenèse, et les infiltrats pulmonaires constituent peut-être une manifestation plus marquée chez certains patients atteints de charbon pulmonaire d'origine bioterroriste. Trois patients ont fait une arythmie supraventriculaire, et trois, un épanchement intrapéricardique mis en évidence par TDM thoracique, dont un a peut-être evolué en tamponnade. Les épanchements intrapéricardiques peuvent correspondre à un œdème ou une inflammation locale causés par la toxine, à une nécrose et un infarctus hémorragiques qui auraient progressé du péricarde jusqu'au médiastin, ou encore à la diffusion hématogène de B. anthracis.
La méningite charbonneuse est une complication du charbon pulmonaire qui a pour particularité d'être toujours hémorragique. Les examens anatomopathologiques montrent une leptoméningite hémorragique accompagnée d'œdème et d'infiltrats inflammatoires (2,23). Chez 55% des patients décédés après l'accident de Sverdlovsk, l'autopsie a mis en évidence une atteinte méningée. Dans notre série, le liquide céphalorachidien n'a été examiné que chez deux patients et la méningite n'a été confirmée que chez l'un d'entre eux. Chez trois autres patients, des périodes de confusion ont été rapportées mais ils n'ont pas présenté de signes méningés et n'ont pas subi de ponction lombaire. Aucun des patients victimes de charbon pulmonaire d'origine bioterroriste ne présentait de maladie ni de trouble sous-jacent majeur. Un patient (Cas No5) avait des antécédents lointains de sarcoïdose mais il était exempt de signes cliniques et de traitement depuis 25 ans. Un autre cas de charbon pulmonaire associé à une sarcoïdose sous-jacente a été rapporté (12). Le patient du (Cas No5) souffrait également de diabète sucré, maladie présente dans un des cas rapportés dans le passé (12). Le fait de fumer ne semble pas constituer un facteur de risque de charbon pulmonaire.
En résumé, nous décrivons le tableau clinique des 10 premiers cas de charbon pulmonaire d'origine bioterroriste aux Etats-Unis. Ce tableau était variable et ressemblait souvent à celui d'une pathologie respiratoire virale, mais l'interprétation des premiers symptômes dans un contexte d'exposition possible à B. anthracis a souvent permis un diagnostic précoce. Contrairement aux rapports antérieurs faisant état d'un taux de mortalité de plus de 85% (1,3), les résultats de nos séries semblent prouver qu'il est possible d'améliorer considérablement le taux de survie par l'administration d'une polyantibiothérapie débutée au cours de la phase initiale de la maladie et par un traitement symptomatique énergique, par exemple le drainage des épanchements pleuraux. Les techniques de diagnostic récentes telles que l'amplification en chaîne par polymérase (PCR), l'immunohistochimie, et les examens sérologiques sensibles apportent une aide précieuse dans le diagnostic des infections à B. anthracis. Des études plus poussées seront nécessaires afin de mieux définir les traitements antibiotiques les plus appropriés, mieux étudier le rôle des traitements adjuvants (par exemple les immunoglobulines antitoxines, corticostéroïdes et autres inhibiteurs de la toxine du charbon) et de mieux comprendre la pathogenèse de la maladie du charbon dans le cadre d'une contamination intentionnelle.
Remerciements
Nous remercions Sherrie Bruce, Rebecca Dixon, Anexis Lopez, Pat McConnon, Carmen Resurreccion, Kay Vydareny, les laboratoires du National Center for Infectious Diseases, les laboratoires des états concernés, le Ministère de la Défense des USA et les officiers du Epidemic Intelligence Service pour l'aide qu'ils ont apportée à la préparation de cet article.
Le Dr. Jernigan est un épidémiologiste médical du National Center for Infectious Diseases, Centers for Disease Control and Prevention, professeur adjoint de médecine, Emory University School of Medicine. Il a largement contribué à l'évaluation clinique des cas de charbon pulmonaire associée à cette épidémie.
Correspondance: John A. Jernigan, NCID, CDC, Mailstop E68, 1600 Clifton Road, N.E., Atlanta, GA 30333 USA; fax: (1) 404-498-1244; e-mail: jjernigan@cdc.gov
Références
- Brachman P. Inhalation anthrax. Ann NY Acad Sci 1980;353:83-93.
- Dixon T, Meselson M, Guillemin J, Hanna P. Anthrax. N Engl J Med 1999;341:815-26.
- Meselson M, Guillemin J, Hugh-Jones M, Langmuir A, Popova I, Shelokov A, et al. The Sverdlovsk anthrax outbreak of 1979. Science 1994;266:1202-8.
- Suffin J, Carnes W, Kaufmann A. Inhalation anthrax in a home craftsman. Hum Pathol 1978;9:594-7.
- Centers for Disease Control and Prevention. Notice to readers: ongoing investigation of anthrax--Florida, October 2001. MMWR Morb Mortal Wkly Rep 2001;50:877.
- Centers for Disease Control and Prevention. Update: investigation of bioterrorism-related anthrax and interim guidelines for clinical evaluation of persons with possible anthrax. MMWR Morb Mortal Wkly Rep 2001;50:941-8.
- Centers for Disease Control and Prevention. Update: investigation of bioterrorism-related anthrax and interim guidelines for exposure management and antimicrobial therapy, October 2001. MMWR Morb Mortal Wkly Rep 2001;50:909-19.
- Centers for Disease Control and Prevention. Update: investigation of anthrax associated with intentional exposure and interim public health guidelines, October 2001. MMWR Morb Mortal Wkly Rep 2001;50:889-93.
- Albrink W, Brooks S, Biron R, Kopel M. Human inhalation anthrax: a report of three fatal cases. Am J Pathol 1960;36:457-71.
- Case records of the Massachusetts General Hospital, case #14032: an acute infection with bloody fluid in the right pleural space. N Engl J Med 1928;198:148-53.
- Brachman P, Plotkin S, Bumford F, Atchison M. An epidemic of inhalation anthrax: the first in the twentieth century. II. Epidemiology. American Journal of Hygiene 1960;72:6-23.
- Brachman P, Pagano J, Albrink W. Two cases of fatal inhalation anthrax, one associated with sarcoidosis. N Engl J Med 1961;265:203-8.
- Fletcher J. Human anthrax in the United States: a descriptive review of case reports, 1955-1999. Rollins School of Public Health. Atlanta: Emory University; 2000.
- Gold H. Anthrax: a report of one hundred seventeen cases. Arch Intern Med 1955;96:387-96.
- LaForce F, Bumford B, Feeley J, Stokes S, Snow D. Epidemiologic study of a fatal case of inhalation anthrax. Arch Environ Health 1969;18:798-805.
- LaForce F. Woolsorter's disease in England. Bull NY Acad Sci 1978;54:956-63.
- Levinsky W, Anderson T, Richardson G. Inhalation anthrax meningitis and bacillemia: a case report. In: Proceedings of the Symposium on Anthrax in Man. Philadelphia, Pennsylvania; 1954 Oct 9. p. 96-103.
- Plotkin S, Brachman P, Utell M, Bumford F, Atchison M. An epidemic of inhalation anthrax, the first in the twentieth century, I. Clinical features. Am J Med 1960;29:992-1001.
- Krane S. Cases from the medical grand rounds of the Massachusetts General Hospital, case 388: sinusitis due to anthrax. American Practitioner and Digest of Treatment 1957;8:1628-36.
- Brooksher W, Briggs J. Pulmonary anthrax: report of a case. JAMA 1920;74:323-4.
- Cowdery J. Primary pulmonary anthrax with septicemia. Archives of Pathology 1947;43:396-9.
- Brachman P, Kaufmann A. Anthrax. In: Evans A, Brachman P, editors. Bacterial infections of humans. New York: Plenum Medical Book Company; 1998. p. 95-107.
- Abramova F, Grinberg L, Yampolskaya O, Walker D. Pathology of inhalational anthrax in forty-two cases from the Sverdlovsk outbreak of 1979. Proc Natl Acad Sci U S A 1993;90:2291-4.
- Albrink W, Goodlow R. Experimental inhalation anthrax in the chimpanzee. Pathology 1959;35:1055-65.
1. Membres de l’équipe qui ont participé aux travaux présentés dans cet article : J. Aguilar, M. Andre, K. Baggett, B. Bell, D. Bell, M. Bowen, G. Carlone, M. Cetron, S. Chamany, B. De, C. Elie, M. Fischer, A. Hoffmaster, K. Glynn, R. Gorwitz, C. Greene, R. Hajjeh, T. Hilger, J. Kelly, R. Khabbaz, A. Khan, P. Kozarsky, M. Kuehnert, J. Lingappa, C. Marston, J. Nicholson, S. Ostroff, T. Parker, L. Petersen, R. Pinner, N. Rosenstein, A. Schuchat, V. Semenova, S. Steiner, F. Tenover, B. Tierney, T. Uyeki, S. Vong, D. Warnock, C. Spak, D. Jernigan, C. Friedman, M. Ripple, D. Patel, S. Pillai, S. Wiersma, R. Labinson, L. Kamal, E. Bresnitz, M. Layton, G. DiFerdinando, S. Kumar, P. Lurie, K. Nalluswami, L. Hathcock, L. Siegel, S. Adams, I. Walks, J. Davies-Coles, M. Richardson, K. Berry, E. Peterson, R. Stroube, H. Hochman, M. Pomeranz, A. Friedman-Kien, D. Frank, S. Bersoff-Matcha, J. Rosenthal, N. Fatteh, A. Gurtman, R. Brechner, C. Chiriboga, J. Eisold, G. Martin, K. Cahill, R. Fried, M. Grossman, and W. Borkowsky.
Figures
Tables
Suggested citation: Jernigan JA, Stephens DS, Ashford DA, Omenaca C, Topiel MS, Galbraith M, et al. Bioterrorism-Related Inhalational Anthrax: The First 10 Cases Reported in the United States [French]. Emerg Infect Dis [serial on the Internet]. 2001, Dec [date cited]. Available from http://wwwnlc.cdc.gov/eid/article/7/6/01-0604.htm
Comments to the EID Editors
Please contact the EID Editors via our Contact Form.
Knowing Which Foods Make Us Sick Will Help Guide Food Safety Regulations
Length: 13:47