Investigadores tratan de identificar células individuales que permitan profundizar el conocimiento sobre el cáncer
> Artículo en inglés
Cuando a los investigadores se les pregunta cuáles son los retos más grandes que enfrentan al tratar de entender mejor el cáncer, una palabra prácticamente salta de la boca de muchos de ellos: la heterogeneidad.
Un tumor, subrayan los investigadores, no es una masa uniforme de células idénticas que se comportan de manera idéntica. Las células pueden actuar de manera muy diferente en diversas partes del tumor. Por ejemplo, los genes de importancia crítica en la proliferación celular puede que estén activos en un área, pero no en otra, o una subpoblación de células cancerosas puede que esté latente y prácticamente se esconda de cualquier fármaco que trate de entrar en su guarida.
Por ejemplo, se ha responsabilizado a esta heterogeneidad por el limitado éxito de las terapias dirigidas y los esfuerzos para identificar mejores marcadores diagnósticos y pronósticos de la enfermedad.
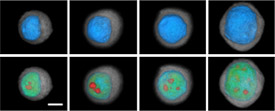
Los investigadores han comenzado a descubrir lo que muchos sospechaban desde hace mucho tiempo: gran parte de lo que hace que los tumores sean heterogéneos en general es que cada célula es fundamentalmente heterogénea.
Hasta hace poco, era casi imposible realizar un estudio meticuloso de células individuales, especialmente debido a la escasez relativa de los componentes clave que deben medirse en cada célula, tales como el ADN y el ARN. Pero gracias a los avances tecnológicos que pueden ayudar a superar algunas de esas limitaciones, una cantidad creciente de investigadores está comenzando a adentrarse más profundamente en la biología de la célula individual.
Los estudios realizados hasta el momento "nos muestran cuánta diversidad hay entre las células cancerosas de un tumor dado", afirmó el doctor Garry Nolan, inmunólogo en la Universidad Stanford, cuyo laboratorio se dedica al trazado de los mapas de las redes de comunicación en las células.
Sin embargo, incluso con el avance de la tecnología, realizar estudios al nivel de la célula individual es difícil y puede requerir mucho tiempo y recursos económicos. Pero con un creciente interés en esta área, y USD$90 millones a lo largo de 5 años otorgados por la iniciativa del Fondo Común de los NIH (NIH Common Fund) (véase recuadro al final de la página), existe un cauteloso optimismo de que en la próxima década la investigación de células individuales puede que comience a dar dividendos y beneficie a pacientes con cáncer y otras enfermedades.
Más allá del promedio
Gran parte de la investigación de la biología molecular de los tumores requiere que se utilicen mezclas de decenas o cientos de miles de células. Esas muestras "tienen células inmunitarias, células endoteliales y otras células infiltrantes, todo lo cual comprende lo que en realidad es un tumor", explicó el doctor Dan Gallahan de la División de Biología Oncológica del NCI. "Eso hace que sea verdaderamente difícil entender lo que define a un tumor o, más importante aún, cómo tratarlo.
Los resultados de estudios sobre una población grande de células, agregó el doctor Gallahan, representan esencialmente una medición promedio.
El estudio de células individuales es una manera de "desafiar el promedio", dijo el doctor Marc Unger, director científico de la firma Fluidigm Corporation, en una conferencia sobre células madre que tuvo lugar a principios de año en Japón. (Fluidigm, una compañía que elabora dispositivos para el análisis de células individuales, y el Instituto Broad anunciaron recientemente planes para establecer un centro de investigación genómica de células individuales).
El análisis de células individuales podría ofrecer importante información clínica, dijo el doctor Nicholas Navin, del Centro Oncológico MD Anderson de la Universidad de Texas, quien ha utilizado técnicas de secuenciación de última generación para estudiar las variaciones en el número de genes (variación de la cantidad de copias) que existen en las células cancerosas individuales.
Gracias a los avances tecnológicos, una cantidad creciente de investigadores está comenzando a adentrarse más profundamente en la biología de las células individuales.
El análisis de células individuales, por ejemplo, ayuda a identificar "poblaciones de células preexistentes que son resistentes a la quimioterapia o subpoblaciones poco comunes que son capaces de invadir tejidos o provocar metástasis", dijo. "Probablemente también podamos cuantificar el alcance de la heterogeneidad en el tumor de un paciente a través de datos de una célula individual y utilizar este índice para predecir la respuesta de un paciente al tratamiento, agregó el doctor Navin.
Los resultados de varios estudios realizados recientemente han resaltado los retos que supone la heterogeneidad de un tumor.
Por ejemplo, investigadores de BGI (conocido en el pasado como Bejing Genomics Institute) secuenciaron las regiones del ADN que codifican la proteína (el exoma) de 20 células cancerosas y 5 células normales de un hombre con cáncer de riñón metastásico. Los investigadores encontraron una diversidad genética impresionante entre las células cancerosas, con muy pocas mutaciones comunes compartidas entre ellas.
Mucho del trabajo en el análisis de células individuales todavía se encuentra en fase preliminar, y todo impacto clínico posible está todavía a años de distancia, afirman los investigadores.
"El problema con los datos de células individuales es que todavía no sabemos verdaderamente qué significan", comentó recientemente el doctor Sangeeta Bhatia, del Instituto de Tecnología de Massachusetts, en Nature Biotechnology.
Y los estudios que abarcan grandes poblaciones de células no desaparecerán en el futuro cercano, anotó la doctora Betsy Wilder, directora de la Oficina de Coordinación Estratégica de los NIH, oficina de supervisa el Fondo Común de los NIH.
"No es necesario realizar un análisis de células individuales por cada pregunta que se plantee", subrayó la doctora Wilder. "Se seguirán realizando estudios con poblaciones de células porque tiene mucho sentido hacerlo".
Tecnología, una fuerza motriz
Más allá de un simple interés en aprender más sobre las células individuales, lo que el doctor Gallaham llamó "las unidades operativas de la biología", la tecnología ha sido la fuerza motriz que impulsa el crecimiento en este campo.
El doctor Stephen Quake, también de Stanford, ha liderado el uso de la microfluídica, una tecnología que típicamente utiliza pequeños chips con válvulas y canales microscópicos, a menudo denominados dispositivos de laboratorios en chips, que permiten a los investigadores identificar y estudiar células individuales. El doctor Quake, quien cofundó Fluidigm, y otros investigadores están utilizando cada vez más estos dispositivos para elaborar los perfiles de las expresiones de los genes y secuenciar el ARN y el ADN de las células individuales.
La investigación del doctor Nolan utiliza un enfoque híbrido que combina dos tecnologías: un método manipulado de citometría de flujo, el cual ha sido utilizado por varias décadas para clasificar las células y realizar análisis limitados de células individuales, y la espectrometría de masas, la cual a menudo se utiliza para identificar y cuantificar las proteínas presentes en las muestras biológicas.
El laboratorio del doctor Nolan está utilizando este enfoque de "citometría de masas", diseñado por el doctor Scott Tanner, de la Universidad de Toronto, para caracterizar la respuesta de las células individuales a diferentes estímulos, tales como las citocinas, los factores de crecimiento y una variedad de fármacos. Gran parte del trabajo del equipo se ha centrado en el análisis de células productoras de sangre normales.
Ellos publicaron un influyente estudio el año pasado en Science que revela algunos de los leves cambios bioquímicos que se dan durante la diferenciación celular. El estudio también describe la manera como el dasatinib (Sprycel), un fármaco utilizado para tratar la leucemia mielógena crónica, afecta ciertas actividades intracelulares. La investigación, afirmó el doctor Nolan, es el preludio del estudio de células individuales de pacientes con cáncer de la sangre. El enfoque, cree el doctor Nolan, podría revelarse parcialmente útil para identificar nuevos medicamentos y para probarlos en el laboratorio.
El tumor no es una masa uniforme de células idénticas que se comportan de manera idéntica. Las células pueden actuar de manera muy diferente en diversas partes del tumor.
El Microscale Life Sciences Center (MLSC), un Centro de Excelencia en Ciencias Genómicas de los NIH, con sede en la Universidad Estatal de Arizona, desarrolla y aplica tecnología de punta para la investigación de células individuales.
El centro, conformado por investigadores del Estado de Arizona, la Universidad de Washington, la Universidad Brandeis y el Centro de Investigación Oncológica Fred Hutchinson, cuenta con investigadores de numerosas disciplinas, entre ellas microfluídica, informática, física, ingeniería y bioquímica, explicó el investigador principial, doctor Deirdre Meldrum.
"Todas estas disciplinas son necesarias para desarrollar las nuevas tecnologías que estamos estudiando", dijo el doctor Meldrum, quien es también ingeniero electricista.
En su trabajo inicial, el MLSC ha medido los procesos metabólicos en células individuales vivas, incluida la respiración celular (proceso mediante el cual las células adquieren energía), en relación con la habilidad de una célula de resistir o sucumbir a la muerte celular. El caballito de trabajo de este esfuerzo es una plataforma denominada Cellarium, diseñada por el equipo del doctor Meldrum. Las células individuales son aisladas en cámaras controladas, explicó el doctor Meldrum, "donde las perturbamos y medimos cómo cambian con el pasar del tiempo".
Los investigadores del MLSC y de otras partes también han creado tecnologías para obtener imágenes de las células individuales. Los científicos del MLSC están utilizando un dispositivo creado por VisionGate, denominado Cell-CT, "con el cual pueden medirse de manera precisa las características celulares en 3D", dijo el doctor Meldrum.
Los investigadores del MLSC han estudiado células esofaríngeas anormales de personas con esófago de Barrett, una enfermedad que aumenta el riesgo de adenocarcinoma del esófago. En particular, han estudiado la manera como estas células responden a niveles muy bajos de oxígeno, o hipoxia.
El reflujo gástrico, que puede provocar esófago de Barrett, puede dañar el esófago" y provocar hipoxia transitoria en el recubrimiento epitelial del esófago", explicó el doctor Thomas Paulson, investigador del Centro Fred Hutchinson. De hecho, agregó, el sistema Cellarium ofrece una imagen de la manera como el ambiente hipóxico selecciona variantes de células que son capaces de sobrevivir y crecer en ese ambiente, lo cual profundiza el conocimiento sobre los factores que inciden en la evolución de las células de normales a cancerosas.
Aun cuando el trabajo del doctor Paulson en el MLSC se centra en el esófago de Barrett, él cree que el enfoque representa un modelo excelente para estudiar el riesgo de cáncer en general.
"En mi opinión, lo que nosotros consideramos un riesgo, probablemente cambiará conforme entendamos los tipos de cambios que se dan en el ámbito de una célula individual" que pueden transformar una célula sana en un célula cancerosa, dijo.
Estudios más profundos en el futuro
En el campo de la práctica se reconoce que, en general, el análisis de células individuales sigue teniendo importantes limitaciones. Se necesitan adelantos tecnológicos que permitan a nivel molecular y estructural realizar los mismos estudios profundos que pueden lograrse a niveles de lotes de células. Y se necesitarán programas informáticos muy avanzados que ayuden a interpretar los datos provenientes de los estudios de células individuales.
Además, la investigación a la larga tendrá que traspasar los confines de la mayoría de los ambientes artificiales en los cuales se analizan las células individuales hoy en día, anotó el doctor Gallahan. "A medida que mejore la tecnología, deberíamos poder trabajar más en ambientes in vivo".
Aun cuando queda mucho trabajo por hacer, lo que puede aprenderse del estudio de células individuales es considerable, cree el doctor Nolan.
"El hecho de que hayamos podido tomar buenas decisiones y aprender tanto, incluso a nivel de las poblaciones de células, significa que hay cosas de mucho más valor que pueden lograrse al estudiar la célula individual", dijo.
—Carmen Phillips
Transformación del campo de estudio de la célula individual
En el mes de septiembre, los Institutos Nacionales de la Salud anunciaron los beneficiarios de las subvenciones del programa de análisis de células individuales del Fondo Común de los NIH.
El programa, el cual ofrece tres oportunidades de financiamiento, "es en gran medida una iniciativa de desarrollo tecnológico", explicó la doctora Wilder. El Fondo Común de los NIH lanzó este programa ahora porque "se entiende que existen las tecnologías que pueden permitirnos hacer el tipo de análisis necesario para estudiar las células individuales en su ambiente natural", como en un trozo de tejido.
Aun cuando los esfuerzos están centrados en la tecnología, una meta importante de la iniciativa es respaldar la investigación que identificará unos cuantos principios generales sobre la manera como se comportan las células individualmente en un ambiente complejo", añadió el doctor Ravi Rasavappa, director del programa para el análisis de células individuales.
Desde el mismo momento de la planificación, estuvo claro que el programa no debía limitarse a los tipos de tecnología en consideración, comentó la doctora Wilder. "Nuestro análisis indicaron que hay una gran cantidad de posibilidades, entonces decidimos dejar todo a la imaginación de los investigadores para determinar qué tecnologías serían las mejores para transformar el campo en general".






 El Boletín del Instituto Nacional del Cáncer acaba de cumplir 3 años de existencia y queremos aprovechar esta oportunidad para agradecerles a nuestros lectores todo el apoyo que nos han brindado durante estos años.
El Boletín del Instituto Nacional del Cáncer acaba de cumplir 3 años de existencia y queremos aprovechar esta oportunidad para agradecerles a nuestros lectores todo el apoyo que nos han brindado durante estos años.